Giao đến
Mẫu mã sản phẩm có thể thay đổi tùy theo lô hàng
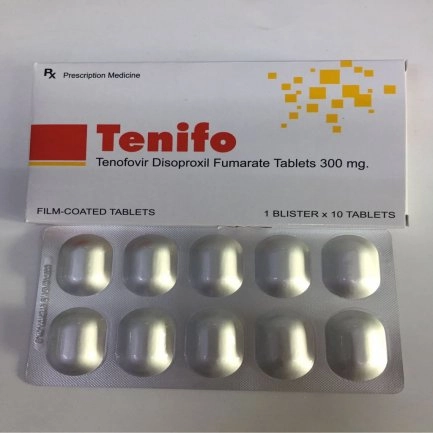
Thuốc kháng virus Tenifo hộp 10 viên
Sản phẩm cần tư vấn từ dược sĩ
Lưu ý:Sản phẩm này chỉ bán khi có chỉ định của bác sĩ. Mọi thông tin trên website và app chỉ mang tính chất tham khảo. Vui lòng liên hệ với bác sĩ hoặc nhân viên y tế để được tư vấn thêm.
Đã duyệt nội dung
Thông tin sản phẩm
Danh mục
Thuốc kháng virus
Thuốc cần kê toa
Có
Hoạt chất
Tenofovir
Dạng bào chế
Viên nén bao phim
Công dụng
Thương hiệu
Atra Pharmaceuticals
Nước sản xuất
Ấn Độ
Hạn dùng
36 tháng kể từ ngày sản xuất. Không dùng thuốc khi đã hết hạn sử dụng.
Mọi thông tin trên đây chỉ mang tính chất tham khảo. Việc sử dụng sản phẩm phải tuân theo hướng dẫn của bác sĩ, dược sĩ hoặc nhân viên y tế.
Công dụng/Chỉ định
Liều lượng và cách dùng
Chống chỉ định
Thận trọng
Sử dụng cho phụ nữ có thai và cho con bú
Ảnh hưởng lên khả năng lái xe và vận hành máy móc
Tác dụng không mong muốn
Tương tác thuốc
Thành phần
Dược lý
Quá liều
Bảo quản
Hạn dùng
Xem thêm
Nhà thuốc uy tín
Giao hàng nhanh chóng
Dược sĩ tư vấn miễn phí
Sản phẩm bạn vừa xem
Medigo cam kết
Giao thuốc nhanh
Đơn hàng của bạn sẽ được giao từ nhà thuốc gần nhất
Đáng tin cậy
Nhà thuốc đạt chuẩn GPP và được Bộ Y Tế cấp phép
Tư vấn nhiệt tình
Dược sĩ sẽ luôn có mặt 24/7 để hỗ trợ bạn mọi vấn đề sức khỏe
Phục vụ 24/7
Bất kể đêm ngày, chúng tôi luôn giao hàng nhanh chóng và an toàn